Log-in
ISO 9001:2015 Certificate number: IT331780
Quasi 340mila tamponi rino-faringei refertati, un kit sierologico (QuantiGEM) per il dosaggio quantitativo di anticorpi IgG e IgM, uno studio di sequenziamento genomico, una ricerca pioneristica sugli effetti della vaccinazione nei pazienti dializzati. Sono solo alcuni dei risultati di Biogem in due anni di lotta al COVID-19, a partire dal 22 aprile 2020, quando fu avviata l’attività di analisi dei tamponi rino-faringei, autorizzata dalla Regione Campania, ed effettuata con tecnica qRT-PCR. Tale analisi, effettuata su tre geni virali del SARS CoV2, è stata realizzata da un team di biologi-ricercatori presso il Laboratorio COVID, appositamente creato, e diretto dal professore Michele Caraglia, con la supervisione di Marianna Scrima e Alessandra Fucci.
La lotta incessante al virus ha tuttavia coinvolto da subito l’intero centro di ricerca irpino, a partire dal laboratorio di Protein Factory, diretto dalla dottoressa Maria Luisa Nolli, con la collaborazione di Simona Giacobbe e di nuovo di Alessandra Fucci. Si deve a questa squadra lo sviluppo di un kit sierologico (QuantiGEM) per il dosaggio quantitativo di anticorpi IgG e IgM contro il SARS COV2 nel sangue umano. COVID 19 QuantiGEM rientra, in particolare, nella tipologia dei test immunoenzimatici ELISA e offre un’elevata sensibilità e specificità diagnostica (del 93,8% per i campioni raccolti fra gli 8 e i 14 giorni dall’infezione e del 100% dopo i 21 giorni).
In collaborazione con la start-up TESTAMI è stato poi introdotto l’utilizzo di tamponi auto-raccolti a casa propria e spediti direttamente ai laboratori di Biogem per l’analisi molecolare. L’iniziativa, scaturita da uno studio, coordinato dal professore Michele Caraglia, ha permesso di semplificare la diagnosi da infezione SARS-CoV2, garantendo un'accuratezza del 97,3%, rispetto ai tamponi nasofaringei standard raccolti dagli operatori sanitari.
Un team di ricercatori Biogem del laboratorio di Oncologia Molecolare e di Precisione, guidato anch’esso dal professore Michele Caraglia, ha invece condotto uno studio di sequenziamento genomico. Il lavoro, dal titolo ‘Genomic characterization of the emerging SARS-CoV-2 lineage in two districts of Campania (Italy) using Next generation sequencing’ pubblicato sulla rivista Frontiers in Virology, ha permesso di individuare la sequenza completa del genoma virale nel SARS-CoV-2, a partire da 101 casi, tra i contagiati nei distretti di Avellino e Benevento. I risultati ottenuti, per i mesi presi in considerazione, hanno contribuito alla determinazione e alla sorveglianza dell’insorgenza di mutazioni genetiche di SARS-CoV-2 in Campania.
Di strettissima attualità è infine uno studio, attualmente in fase di pubblicazione, coordinato dal Direttore Scientifico di Biogem, Giovambattista Capasso, dal titolo ‘The DiaCoVAb study in South Italy: immune response to SARS-CoV-2 vaccination in dialysis patients’. Tale ricerca, tra le prime in questo campo, ha definito una diversa strategia di vaccinazione per i pazienti in dialisi, in termini di dose e tempo di somministrazione, suggerendo la necessità di un richiamo e prospettando la riduzione dell'intervallo di tempo dalla seconda dose.
Alessia Maria Cossu
Ettore Zecchino
Un team di ricercatori del centro di ricerca irpino, guidato dal professore Michele Caraglia, ha identificato dieci ceppi di SARS-CoV2 mediante il sequenziamento dell’intero genoma virale nel periodo gennaio-maggio 2021, nei distretti di Avellino e Benevento. Nonostante la straordinaria velocità nello sviluppo di vaccini contro il COVID-19 e pur con sforzi di vaccinazione di massa nel mondo, l'emergere di queste varianti compromette i progressi registrati nella guerra al virus. Il sequenziamento dell'intero genoma (WGS) svolge un ruolo cruciale nella comprensione della malattia, e l'utilizzo, da parte di Biogem, di un algoritmo chiamato Phylogenetic Assignment of Named Global Outbreak LINEages (Pangolin) è particolarmente utile per le indagini, definendo un cluster filogenetico. Sulla base dell'aggiornamento epidemiologico OMS del giugno 2021, quattro diverse varianti principali di SARS-CoV-2 erano state identificate dall'inizio della pandemia: Alpha (B.1.1.7), descritta nel Regno Unito (UK) a fine dicembre 2020; Beta (B.1.351), identificata per la prima volta in Sud Africa nel dicembre 2020; Gamma (P.1), comparsa in Brasile all'inizio di gennaio 2021; Delta (B.1.617.2), rilevata in India nel dicembre 2020.
Lo studio di Biogem, dal titolo ‘Genomic characterization of the emerging SARS-CoV-2 lineage in two districts of Campania (Italy) using Next generation sequencing’ e appena pubblicato sulla rivista Frontiers in Virology, ha consentito di individuare la sequenza completa del genoma virale nel SARS-CoV-2, a partire da 101 casi, tra i contagiati nei distretti di Avellino e Benevento. All'inizio dell’epidemia (gennaio e febbraio 2021), la variante Alpha era presente nel 62% dei 35 campioni analizzati nel Beneventano, mentre questo ceppo compare ad Avellino solo in un secondo momento (da marzo a maggio) nel 64% dei 36 campioni analizzati.
La diffusione della variante Gamma, sempre nel periodo marzo-maggio 2021, è stata invece registrata in tutti i distretti con le stesse frequenze (circa il 21%). Sono state inoltre identificate 219 mutazioni missenso (sostituzione di una base azotata nel filamento di DNA) ‘note’ con differenti frequenze (114 in ORF 1a/1b; 12 in ORF 3a; 29 in S; 5 in M; 29 in N; e 5 ciascuna in ORF7a e ORF8).
I risultati ottenuti rivelano, per i mesi presi in considerazione dallo studio, la rapida diffusione in Campania di nuove varianti, e suggeriscono di sorvegliare con attenzione l'insorgenza delle varie mutazioni genetiche di SARS-CoV-2.
Alessia Maria Cossu
Ettore Zecchino
Ultimamente si parla sempre più spesso della variante Omicron, chiedendosi quanto sia pericolosa in termini di trasmissibilità e gravità e interrogandosi sul suo potenziale di eludere i vaccini e causare reinfezione. Il mese scorso, gli scienziati in Botswana e in Sudafrica hanno allertato il mondo su una variante SARS-CoV-2 a rapida diffusione, ora nota come Omicron. Nel primo giorno di dicembre, il Sudafrica registrava 8.561 casi, in aumento rispetto ai 3.402 segnalati il 26 novembre, e diverse centinaia al giorno a metà novembre, con gran parte della crescita avvenuta nella provincia di Gauteng, in cui ha sede Johannesburg. Ad oggi, i casi confermati di Omicron sono stati segnalati in più di 38 Paesi e il loro numero sembra essere in rapido aumento.
SARS-CoV-2 Omicron potrebbe dare origine alla quarta ondata dell'epidemia di COVID-19 che si sta diffondendo in tutto il mondo, dopo i VOC D614G, Beta/Gamma e Delta. I ricercatori stanno sequenziando più genomi SARS-CoV-2 per rilevare l'Omicron, ma la sorveglianza attraverso il sequenziamento genomico può essere lenta e irregolare, complicando il quadro di come e dove si diffonde Omicron.
Lo scorso aprile, a circa 16 mesi dall'inizio della pandemia, un database online appartenente all'iniziativa di scienza dei dati GISAID conteneva un milione di sequenze genomiche SARS-CoV-2. Da allora, i ricercatori hanno sottoposto a GISAID altri cinque milioni di sequenze in circa otto mesi, un aumento di quasi dieci volte del tasso.
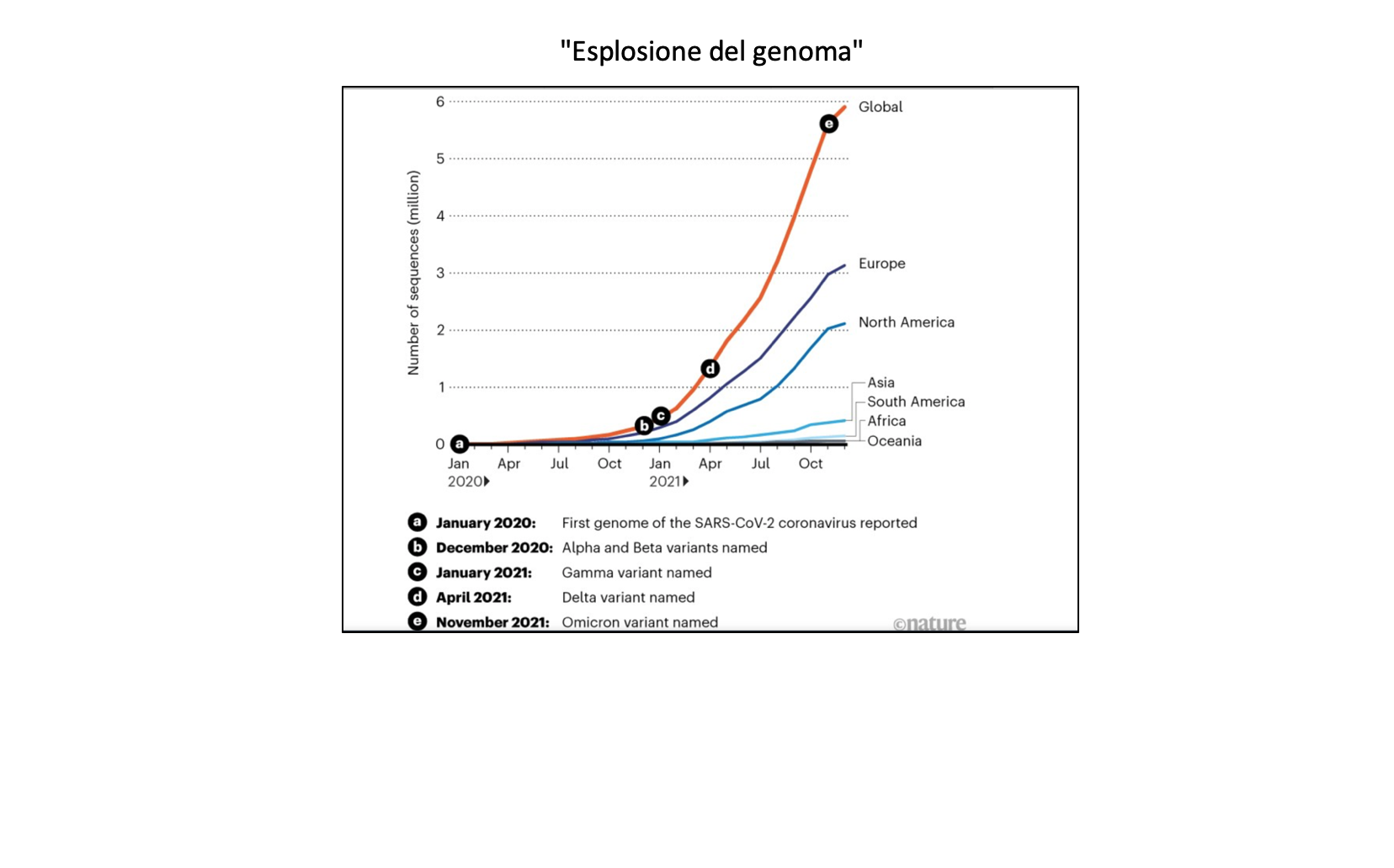
Gli scienziati hanno utilizzato due tipi di analisi di laboratorio per verificare quanto Omicron possa eludere gli anticorpi neutralizzanti o bloccanti i virus. Un approccio utilizza particelle infettive SARS-CoV-2, tipicamente isolate da individui infettati da Omicron. L'altro si basa su particelle di pseudovirus, versioni geneticamente modificate di un altro virus (spesso HIV) che utilizzano la proteina Spike SARS-CoV-2 per infettare le cellule.
I risultati dei quattro team coinvolti nello studio hanno suggerito che Omicron attenua la potenza degli anticorpi neutralizzanti in modo più esteso rispetto a qualsiasi altra variante di SARS-CoV-2 in circolazione. L'entità dell'impatto di Omicron variava tra gli studi condotti su sangue di persone con diverse storie di vaccinazione e infezione. Il team di Sigal ha scoperto che le persone già infettate prima della vaccinazione tendevano ad avere livelli più elevati di anticorpi neutralizzanti contro Omicron, rispetto alle persone vaccinate senza storia nota di infezione. Omicron può schivare gli anticorpi neutralizzanti. Ciò non significa che le risposte immunitarie innescate dalla vaccinazione e dall'infezione precedente non offriranno alcuna protezione contro la variante. Gli studi sull'immunità suggeriscono che livelli modesti di anticorpi neutralizzanti possono proteggere le persone da forme gravi di COVID-19, come afferma Miles Davenport, immunologo dell'Università del New South Wales di Sydney, in Australia.
Altri aspetti del sistema immunitario, in particolare le cellule T, possono essere meno influenzati dalle mutazioni di Omicron rispetto alle risposte anticorpali. I ricercatori in Sudafrica hanno in programma di misurare l'attività delle cellule T e di un altro ‘attore’ immunitario chiamato ‘cellule natural killer’, potenzialmente rilevante per la protezione contro il COVID-19 grave, come affermato da Shabir Madhi, vaccinologo presso l'Università del Witwatersrand.
Attualmente, le domande ricorrenti sono:
Gli attuali booster miglioreranno la protezione contro Omicron?
Omicron causa malattie più lievi o più gravi rispetto alle varianti precedenti?
La minaccia di Omicron ha spinto molti Paesi ad accelerare e ampliare il lancio delle dosi di richiamo del vaccino COVID, pur non essendo ancora chiara la loro efficacia contro questa variante.
I primi rapporti collegavano Omicron a una malattia lieve, facendo sperare che la variante potesse essere meno grave di alcuni dei suoi predecessori. Questi rapporti, però, possono essere fuorvianti poiché si basano su aneddoti o scarsi frammenti di dati, come avverte Müge Çevik, specialista in malattie infettive presso l'Università di St Andrews, nel Regno Unito. "Tutti stanno cercando di trovare alcuni dati che potrebbero guidarci", dice. "Ma è molto difficile in questo momento." Queste evidenze dovrebbero attirare un'ampia attenzione per monitorare l’epidemia e accelerare lo sviluppo di vaccini mirati a Omicron.
Alessia Maria Cossu - PhD-Biogem
Un nuovo vaccino a base proteica è stato sviluppato dalla società di biotecnologie Novavax, a Gaithersburg, nel Maryland (USA). Sebbene queste tipologie di vaccino non siano ancora ampiamente utilizzate per il COVID-19, i dati degli studi clinici in fase avanzata finora sembrano promettenti. D’altra parte, a differenza delle tecnologie relativamente nuove, su cui si basano le iniezioni di mRNA e del vettore virale COVID-19, i vaccini proteici sono stati utilizzati per decenni contro epatite, fuoco di Sant'Antonio e altre infezioni virali. Per suscitare una risposta immunitaria protettiva, questi forniscono proteine, insieme ad adiuvanti che stimolano l'immunità, direttamente alle cellule di una persona.
Nel dettaglio, NVX-CoV2373 è un esempio di vaccino nanotecnologico proteico ricombinante da inserire negli studi clinici sull'uomo, ed è stato costruito a partire dall'intera lunghezza del SARS-tipo ‘selvaggio’ (ceppo di un virus naturale e non mutato). La glicoproteina spike di CoV-2 e la tecnologia delle nanoparticelle ricombinanti di Novavax Inc. sono state brevettate con l'adiuvante Matrix M, una particella di matrice adiuvante a base di saponina, formata dalla formulazione di Quillaja saponaria Molina, con colesterolo e fosfolipidi, per migliorare la risposta immunitaria. La tecnologia delle nanoparticelle ricombinanti Novavax ha generato un antigene derivato dalla glicoproteina spike SARS-CoV-2, che media un attacco virale ai recettori dell'enzima di conversione dell'angiotensina umano 2 (hACE2) all'ingresso delle cellule dell'ospite. Il sistema immunitario è quindi stimolato a produrre anticorpi neutralizzanti, risultati quattro volte superiori rispetto a quanto emerso nel siero dei pazienti convalescenti con COVID-19. Gli studi clinici sull'uomo presentano inoltre effetti collaterali e reattogenicità sistemica solo da lievi a moderati.
I vaccini basati sulla nanotecnologia risultano essere semplici da progettare, da sintetizzare o aumentare di volume rispetto agli approcci vaccinali tradizionali (ad esempio, ceppi inattivati e attenuati dal vivo). La nanotecnologia ha quindi un grande potenziale per affrontare l'epidemia di COVID-19 e può essere cruciale per prevenire nuove epidemie.
La certezza delle differenze tra un vaccino a mRNA (Pfizer-Moderna) e un altro, di tipo proteico, si avrà, comunque, solo dopo il completamento di opportuni studi di confronto.
Alessia Maria Cossu - PhD-Biogem
L’azienda statunitense Pfizer sta conducendo uno studio di fase 2/3 per testare gli effetti indotti da un suo farmaco antivirale sperimentale con assunzione orale, allo scopo di prevenire l'infezione da Covid-19 nei soggetti esposti al virus. Nel dettaglio, il progetto ‘Epic-Pep’ ha avuto inizio nel marzo 2021, portando il farmaco PF-07321332 a uno studio di fase 1 su adulti sani, per valutare la sicurezza, la tollerabilità e la farmacocinetica del composto sperimentale. A luglio è passato a uno studio di fase 2/3, EPIC-HR (Valutazione dell'inibizione della proteasi per COVID-19 in pazienti ad alto rischio), per valutare l'efficacia e la sicurezza, in combinazione con ritonavir, nei partecipanti con una diagnosi confermata di Infezione da SARS-CoV-2 ad alto rischio di progressione verso una malattia grave. Ad agosto, Pfizer ha avviato uno studio di fase 2/3, EPIC-SR (Valutazione dell'inibizione della proteasi per COVID-19 in pazienti a rischio standard), per valutare l'efficacia e la sicurezza nei partecipanti con una diagnosi confermata di infezione da SARS-CoV-2 che sono a rischio standard (cioè, non hanno fattori di rischio per malattie gravi). Mikael Dolsten, Chief Scientific Officer e President, Worldwide Research, Development and Medical di Pfizer ha sottolineato l’esigenza di trovare trattamenti efficaci per le persone che contraggono, o che sono state esposte al virus parallelamente al vaccino. Questa terapia potrebbe aiutare a fermare il virus in anticipo, prima che esso abbia la possibilità di replicarsi, prevenendo potenzialmente la malattia sintomatica in coloro che sono stati esposti, e inibendo l'insorgenza dell'infezione in altri. Il farmaco in questione è un inibitore della proteasi - PF-07321332, co-somministrato a bassa dose di ritonavir (inibitore della proteasi già ampiamente usato per l'Hiv) da valutare all'interno di nuclei familiari con almeno un paziente Covid-19. Tra i vantaggi del PF-07321332 ci sarebbero la tempestività e la facile somministrazione in seguito all’esposizione a Sars-CoV-2, senza richiedere il ricovero in ospedale dei pazienti.
Lo studio Epic-Pep è uno studio randomizzato, in doppio cieco, controllato con placebo, e arruolerà fino a 2.660 partecipanti adulti sani, di età pari o superiore a 18 anni. I partecipanti saranno assegnati in modo casuale a ricevere il candidato antivirale o un placebo per via orale, due volte al giorno, per 5 o 10 giorni. L'obiettivo primario è valutare la sicurezza e l'efficacia per la prevenzione dell'infezione da Sars-CoV-2 e dei suoi sintomi fino al quattordicesimo giorno.
Il programma globale Epic ha più studi clinici in corso, tra cui uno su pazienti infetti da Sars-CoV-2 ad alto rischio di malattia grave (e ricovero in ospedale o morte), iniziato nel luglio 2021 e un altro in pazienti infetti che sono a rischio standard (cioè non hanno fattori di rischio per malattie gravi), avviato nell'agosto 2021.
Alessia Maria Cossu PhD-Biogem
Pagina 1 di 4